O efeito fotoelétrico é a emissão de elétrons por um material, geralmente metálico, quando exposto a uma radiação eletromagnética (como a luz) de frequência
suficientemente alta, que depende do material. Ele pode ser observado
quando a luz incide numa placa de metal, literalmente arrancando
elétrons da placa. Observado pela primeira vez por A. E. Becquerel em 1839 e confirmado por Heinrich Hertz em 1887, o fenômeno é também conhecido por "efeito Hertz", não sendo porém este termo de uso comum.
Os elétrons que giram à volta do núcleo atômico
são aí mantidos por forças de atração. Se a estes for fornecida energia
suficiente, eles abandonarão as suas órbitas. O efeito fotoelétrico
implica que, normalmente sobre metais, se faça incidir
um feixe de radiação com energia superior à energia de remoção dos
elétrons do metal, provocando a sua saída das órbitas: sem energia
cinética (se a energia da radiação for igual à energia de remoção) ou
com energia cinética, se a energia da radiação exceder a energia de
remoção do elétrons.
A grande dúvida que se tinha a respeito do efeito fotoelétrico era
que quando se aumentava a intensidade da luz, ao contrário do esperado, a
luz não arrancava os elétrons do metal com maior energia cinética. O
que acontecia era que uma maior quantidade de elétrons era ejetado.
Por exemplo, a luz vermelha de baixa frequência estimula os elétrons
para fora de uma peça de metal. Na visão clássica, a luz é uma onda
contínua cuja energia está espalhada sobre a onda. Todavia, quando a luz
fica mais intensa, mais elétrons são ejetados, contradizendo, assim a
visão da física clássica que sugere que os mesmos deveriam se mover mais
rápido (energia cinética) do que as ondas.
Quando a luz incidente é de cor azul, essa mudança resulta em
elétrons muito mais rápidos. A razão é que a luz pode se comportar não
apenas como ondas contínuas, mas também como feixes discretos de energia
chamados de fótons.
Um fóton azul, por exemplo, contém mais energia do que um fóton
vermelho. Assim, o fóton azul age essencialmente como uma "bola de
bilhar" com mais energia, desta forma transmitindo maior movimento a um
elétron. Esta interpretação corpuscular da luz também explica por que a
maior intensidade aumenta o número de elétrons ejetados - com mais
fótons colidindo no metal, mais elétrons têm probabilidade de serem
atingidos.
A explicação satisfatória para esse efeito foi dada em 1905, por Albert Einstein, e em 1921 deu ao cientista alemão o prêmio Nobel de Física.
Equações
Analisando o efeito fotoelétrico quantitativamente usando o método de Einstein, as seguintes equações equivalentes são usadas:
Energia do fóton = Energia necessária para remover um elétron + Energia cinética do elétron emitido
Algebricamente:
- h é a constante de Planck,
- f é a frequência do foton incidente,
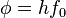 é a função trabalho, ou energia mínima exigida para remover um elétron de sua ligação atômica,
é a função trabalho, ou energia mínima exigida para remover um elétron de sua ligação atômica, é a energia cinética máxima dos elétrons expelidos,
é a energia cinética máxima dos elétrons expelidos,- f0 é a frequência mínima para o efeito fotoelétrico ocorrer,
- m é a massa de repouso do elétron expelido, e
- vm é a velocidade dos elétron expelidos.
- Se a energia do fóton (hf) não é maior que a função trabalho (
 ), nenhum elétron será emitido. A função trabalho é ocasionalmente designada por
), nenhum elétron será emitido. A função trabalho é ocasionalmente designada por  .
. - Em física do estado sólido costuma-se usar a energia de Fermi e não a energia de nível de vácuo como referencial nesta equação, o que faz com que a mesma adquira uma forma um pouco diferente.
- Note-se ainda que ao aumentar a intensidade da radiação incidente não vai causar uma maior energia cinética dos elétrons (ou electrões) ejectados, mas sim um maior número de partículas deste tipo removidas por unidade de tempo.
Ver também
- Célula fotoelétrica
- Espectroscopia de elétrons
- Espectroscopia de fotoelétrons excitados por raios X
- Função trabalho
- Energia de limiar de fotoemissão
Origem: Wikipédia, a enciclopédia livre.
Ler : Efeito fotoelétrico no wikipédia em inglês traduzido pelo google


Nenhum comentário:
Postar um comentário